Depuis le 1er juillet 2021, l'accès précoce aux médicaments innovants est accordé par la HAS après avis de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) sur leur présomption d'efficacité et de sécurité. Dix mois après l'entrée en vigueur de cette réforme prévue par la loi de financement de la sécurité sociale pour 2021, la HAS et l'ANSM dressent un premier bilan positif de ce dispositif qui permet d'accélérer et faciliter l'accès des patients aux médicaments innovants : près de 100 demandes déposées, des évaluations et des décisions rendues dans des délais courts (60 jours en moyenne, 35 pour les traitements de la Covid-19) et 40 médicaments rendus accessibles. Fort de ces constats, et dans un souci d'affiner encore le dispositif, la HAS, après échange avec l'ANSM, fait évoluer certains principes d'évaluation décrits dans sa doctrine.
La HAS et l'ANSM publient aujourd'hui un premier bilan du dispositif d'autorisation d'accès précoce (AAP) aux médicaments, mis en place le 1er juillet 2021. En 10 mois, une centaine de demandes d'autorisation d'accès précoce (pré-AMM et post-AMM) ont été déposées par les laboratoires pharmaceutiques auprès de la HAS. Au 30 avril, 50 décisions avaient déjà été rendues, aboutissant dans 80% des cas à un octroi d'AAP. Ces autorisations concernent des médicaments innovants qui répondent à des besoins non couverts et pour des maladies graves, rares ou invalidantes. Elles profitent donc directement aux patients en leur permettant un accès rapide à un médicament pour lequel il n'y a pas d'alternative.
Dès l'été et la création de ce nouveau dispositif, la HAS et l'ANSM ont ainsi autorisé des médicaments porteurs d'espoir pour des patients en impasse thérapeutique. La HAS a accordé par exemple, après analyse de l'ANSM, des autorisations d'accès précoce à Trodelvy® et à Keytruda® (voir le communiqué de presse), médicaments bénéficiant potentiellement aux milliers de femmes atteintes chaque année d'un cancer du sein métastatique triple négatif ; au Ronapreve® (voir le communiqué de presse), traitement efficace sur le variant Delta de la Covid-19 et dont l'accès précoce, accordé très rapidement, a permis de rendre accessible ce traitement en pleine vague de ce même variant, évitant à certains patients de contracter des formes graves de la maladie ; ou encore l'association Kaftrio®/Kalydeco® (voir le communiqué de presse) qui représente un réel espoir dans le traitement de la mucoviscidose de certains patients de plus de 6 ans.
Autre point de satisfaction : le délai d'instruction des dossiers est court, permettant un accès rapide aux traitements innovants. Alors que le délai d'instruction réglementaire est fixé à 90 jours, les deux agences affichent ensemble des délais moyens constatés de l'ordre de 60 jours. Concernant les produits visant à traiter ou à prévenir les formes sévères de la Covid-19, pour satisfaire à la nécessité de répondre au plus vite à ce besoin médical, le délai moyen a même été réduit à 35 jours.
A noter également que, sur les 50 décisions rendues, 23 ont été alimentées par la contribution écrite d'une association de patients et 11 associations ont été auditionnées par la commission de la transparence.
Au vu de ce premier bilan, mais également des retours issus du dialogue constant avec l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) d'une part, avec les industriels d'autre part, ou encore avec les représentants des associations de patients, la HAS fait évoluer ses principes d'évaluation.
Ainsi, dans sa nouvelle version, la doctrine de la HAS en matière d'accès précoce présente des critères et sous-critères affinés pour juger de la présence ou de l'absence d'un traitement approprié, notamment, au regard de l'expérience acquise sur les premiers dossiers. Aussi, de façon exceptionnelle, notamment lorsqu'un traitement est susceptible de répondre à une urgence sanitaire, les options thérapeutiques cliniquement pertinentes peuvent ne pas être considérées comme des traitements appropriés.
L'autre modification majeure apportée à la doctrine porte sur la présomption d'innovation. La doctrine précise désormais qu'un médicament susceptible d'être innovant dans le cadre d'une autorisation d'accès précoce doit?remplir les trois conditions suivantes complétées des ajouts indiqués en caractères gras :
Au regard de la diversité des situations cliniques rencontrées au cours des 10 premiers mois d'exercice, la HAS confirme qu'une définition unique de présomption d'innovation n'est pas possible. Dans ce contexte, la HAS apprécie différentes composantes en tenant compte notamment des spécificités de certains domaines thérapeutiques pour lesquels le besoin médical est majeur au regard de la mortalité et de la morbidité de la pathologie.
Retrouvez la nouvelle version de la doctrine d'évaluation de la HAS relative aux autorisations d'accès précoce sur le site internet de la HAS : Autorisation d'accès précoce aux médicaments - Doctrine d'évaluation de la HAS
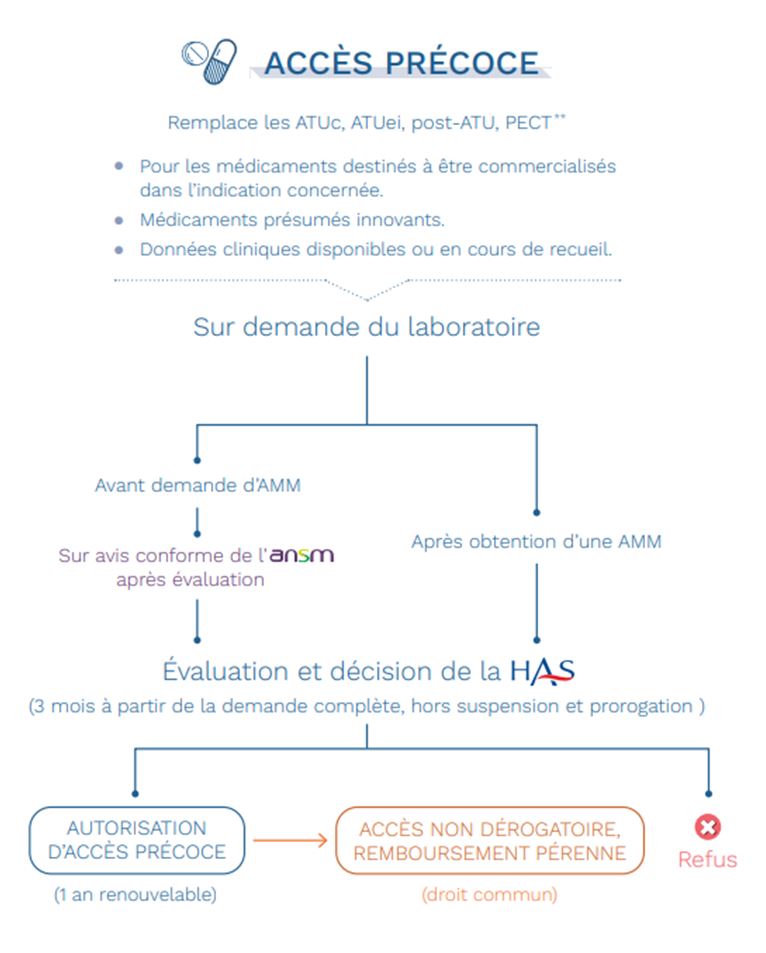
L'autorisation d'accès précoce (AAP) est un dispositif dérogatoire exceptionnel qui permet la mise à disposition et la prise en charge financière d'un médicament (dans une ou plusieurs indications) avant son remboursement par l'Assurance maladie dans le cadre du droit commun. L'objectif est d'accélérer l'accès à ce médicament pour les patients. Une autorisation d'accès précoce peut être accordée sur demande du laboratoire pour un traitement qui remplit chacune des conditions suivantes (précisées à l'article L.5121-12 du Code de la santé publique) :
Le premier critère est évalué par l'ANSM, les quatre autres par la HAS.
Deux cas de figures sont possibles :
Dans tous les cas, le laboratoire pharmaceutique qui fait une demande d'accès précoce s'engage à mettre le médicament à disposition des patients dans les 2 mois suivant l'octroi de l'accès précoce et à déposer une demande d'inscription au remboursement dans le mois suivant l'obtention de l'AMM.
Suivez l'actualité de l'emploi et de la formation dans le secteur des métiers de le santé, du social et des SAP